
Blutdrucktagebuch (DiGA)
Entwicklung einer Digitalen Gesundheitsanwendung (DiGA) als Blutdrucktagebuch für mobile Geräte (iOS, Android).

Seit 2009 begleiten wir unsere Kunden bei der Entwicklung innovativer HMI-Lösungen in der Medizintechnik. Gerne unterstützen wir auch Ihr Software-Projekt von Beginn an bei der Neu- oder Weiterentwicklung von Desktop-, Embedded-, oder mobilen Applikationen.
In unseren langjährigen Projekten arbeiten wir auf Augenhöhe als verlängerte Werkbank, Prozess- und Technologieberater und als Sparringspartner.
Für die Sicherstellung einer reibungslosen Inverkehrbringung Ihres Medizinproduktes berücksichtigen wir die folgenden Normen und Standards. Wir halten die europäischen Verordnungen über Medizinprodukte (Medical Device Regulation, MDR) und In-vitro-Diagnostika (In Vitro diagnostic, IVDR) ein.
Das Bundesministerium für Gesundheit (BMG) unterstreicht im Rahmen der Digitalisierungsstrategie für das Gesundheitswesen und die Pflege die Wichtigkeit von digitalen Gesundheits- und Pflegeanwendungen (DiGA/DiPA). Zudem steht die künftige Interoperabilitätsforderung mit der elektronischen Patientenakte (ePA) im Fokus. Wir unterstützen bei der normgerechten, nutzerzentrierten Entwicklung entsprechend sicherer Anwendungen für die Cloud bis hin zur Anbindung von Edge-Devices.
Für Design und Herstellung von Medizinprodukten ist ein umfassendes Qualitätsmanagement System erforderlich. Fokussiert wird die Produktsicherheit und -wirksamkeit.
Mindestanforderungen an die wichtigsten Software-Lebenszyklus-Prozesse (Entwicklung, Wartung, Risikomanagement, Software Konfigurationsmanagement und die Problemlösung bei Software).
Um die Gefährdungen, die mit Medizinprodukten verbunden sind, zu erkennen, müssen die Risiken abgeschätzt, bewertet und regelmäßig kontrolliert.
Für so genannte Stand-Alone-Software wird hier ein Verfahren nahe gelegt, das Risiken identifiziert und beherrscht, die bei der Benutzung der Software auftreten könnten.
Medizinische Software ist hoch komplex. Das sollte das User Interface aber nicht sein. Anwender sind in ihren alltäglichen Situationen auf eine intuitive Bedienung angewiesen.
Die Richtlinien zur Ergonomie der Mensch-System-Schnittstelle (HMI) sowie Grundsätze der Dialoggestaltung sind wichtige Bestandteile bei der User Interface Konzeption (UI/UX).
Bei der Umsetzung Ihrer Medizinprodukte verzichten wir weitestgehend auf Lasten- und Pflichtenhefte. Stattdessen steht der agile Ansatz im Vordergrund, sodass wir Ihr Produkt schnell und qualitativ hochwertig zur Marktreife bringen. Um den Dokumentationsanforderungen medizinischer Software nach MDR, IVDR, ISO 13485 und IEC 62304 gerecht zu werden, setzen wir Application Lifecycle Management-Systeme (ALM) und/oder Ticket-Systeme nach definierten Qualitätsmanagement-Prozessen ein.
Unser Team ist hier, um Sie zu begleiten, Ihre Ziele zu erreichen und Ihre Visionen Wirklichkeit werden zu lassen. Durch unsere maßgeschneiderten Lösungen und unsere Expertise unterstützen wir Sie dabei, Ihren Erfolg zu steigern. Kontaktieren Sie uns noch heute, um mehr zu erfahren. Wir freuen uns darauf, von Ihnen zu hören und Ihnen weiterzuhelfen.

Entwicklung einer Digitalen Gesundheitsanwendung (DiGA) als Blutdrucktagebuch für mobile Geräte (iOS, Android).

Konzeption und Design eines HMI (Human-Machine-Interface) für einen AED-Prozess für Kinder und Erwachsene.
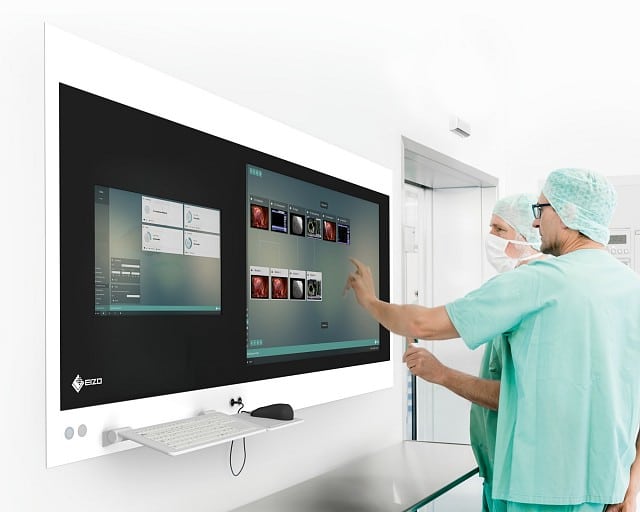
Entwicklung einer Software zum berührungslosen Umschalten eines Monitor-Layouts in Operationssälen mittels Handgesten und Sprachbefehlen.
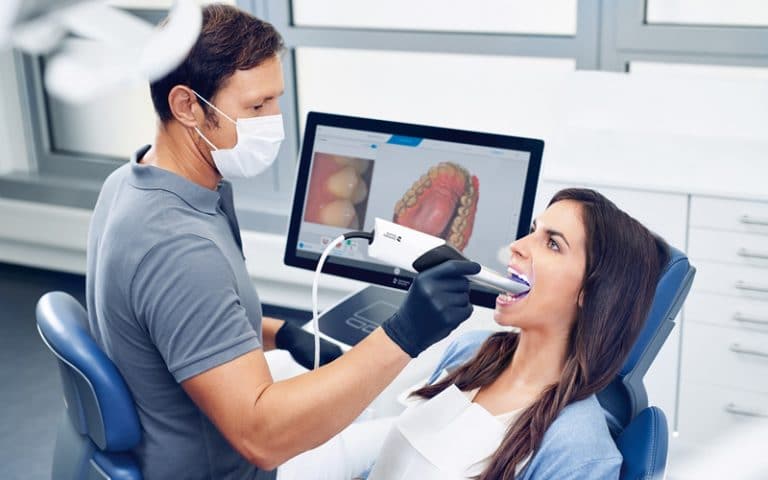
GUI-Entwicklung einer 3D-CAD/CAM-Desktop-Software für die Dental-Branche.
CONZE Informatik GmbH
Friedrichstraße 18
57072 Siegen
Deutschland
+49 (0) 271 240098-50
+49 (0) 271 240098-80
info@conze.com
Geschäftszeiten:
Werktags 08:00 – 18:00 Uhr
CONZE ist Bronze-Sponsor der German UPA in 2024
Herzenswünsche und strahlende Kinderaugen
20. Siegerländer AOK Firmenlauf
Sachbearbeiter Finanzbuchhaltung und Personalwesen
GUI Softwareentwickler C++ / Qt
Frontend Softwareentwickler Flutter / Dart